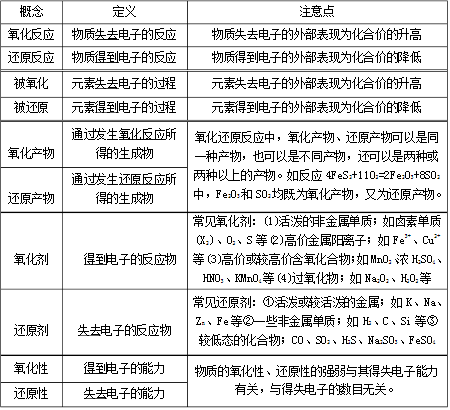
氧化-還原反應是化學反應前后,元素的氧化數有變化的一類反應。

凡是有元素化合價升降的反應都是氧化還原反應。
氧化還原反應的本質:電子的轉移(包括電子的得失和電子對的偏移)
氧化還原反應的特征:化合價的升降(這也是氧化還原反應判斷的依據)
在氧化還原反應中,氧化反應和還原反應是同時進行的。
對于物質所含元素化合價升高的反應是氧化反應,對于物質所含元素化合價降低的反應是還原反應。
在這個反應中,鐵元素的化合價從0價升高到了+2價,發生了氧化反應;銅元素的化合價從+2價降到0價,發生了還原反應。
(1)電子得失守恒規律:氧化劑得到電子總數=還原劑失去電子總數;
(2)“以強制弱”規律:氧化劑+還原劑=較弱氧化劑+較弱還原劑;這是氧化還原反應發生的條件。
(3)價態歸中規律:同一元素不同價態間發生的氧化還原反應,化合價的變化規律遵循:高價+低價→中間價態,中間價態可相同、可不同,但只能靠近不能相互交叉(即價態向中看齊)。
KClO3+6HCl =KCl+3Cl2+3H2O 而不是KClO3+6HCl=KCl+3Cl2+3H2O
(4)歧化反應規律:發生在同一物質分子內、同一價態的同一元素之間的氧化還原反應,叫做歧化反應。其反應規律是:所得產物中,該元素一部分價態升高,一部分價態降低,即“中間價→高價+低價”。具有多種價態的元素(如氯、硫、氮和磷元素等)均可發生歧化反應,如:
Cl2十2NaOH=NaCl十NaClO十H20
(5)優先反應原理:
在溶液中如果存在多種氧化劑(還原劑),當向溶液中加入一種還原劑(或氧化劑)時,還原劑(或氧化劑)先把氧化性(或還原性)強的氧化劑(或還原劑)還原(或氧化)。
以上就是小編整理的氧化還原反應知識點,感謝閱讀。

酸度或者堿度對氧化還原反應有促進或抑制作用。氧化還原反應是化學反應前后,元素的氧化數有變化的一類反應。氧化還原反應的實質是電子的得失或共用電...

通常條件下,氧化還原反應總是由較強的氧化劑與還原劑向著生成較弱的氧化劑和還原劑方向進行。從電極電勢的數值來看,當氧化劑電對的電勢大于還原劑電...

升失氧還,降得還氧。升失氧,降得還,劑性正相反,氧化還原不可分,得失電子是根本。失電子者被氧化,得電子者被還原。失電子者還原劑,得電子者氧化...

氧化還原反應是化學反應前后,元素的氧化數有變化的一類反應。氧化還原反應的實質是電子的得失或共用電子對的偏移。根據作為氧化劑的元素和作為還原劑...

氧化還原反應是化學中三大基本反應之一,其實質是電子的得失或共用電子對的偏移。自然界中的燃燒,生產生活中的金屬冶煉等都與氧化還原反應息息相關。

小編為大家整理了有關氧化還原的知識點,大家跟隨小編來看一下吧。

一個化學反應,是否屬于氧化還原反應,可以根據反應是否有氧化數的升降,或者是否有電子得失與轉移判斷。如果這兩者有沖突,則以前者為準。氧化-還原...

氧化還原反應是化學反應前后,元素的氧化數有變化的一類反應。接下來小編給大家分享一些初中氧化還原反應方程式。