由于格式問題此試題可能會出現亂碼的情況
為了方便您閱讀請點擊右上角的全屏查看
2018秦皇島市中考化學模擬試題
一、選擇題(每小題2分,共40分,每小題只有一個選項符合題意)
1.下列家庭常用物質中,屬于純凈物的是( )
A.黃金????????????? B.食醋????????????? C.蒸餾水????????????? D.紅牛
2.下列常見的物質與水混合,能形成溶液的是( )
A.白糖????????????? B.植物油????????????? C.牛奶????????????? D.沙子
3.下列物質中,不屬于合金的是( )
A.不銹鋼????????????? B.純鐵????????????? C.硬鋁????????????? D.生鐵
4.下列物質不可能與水形成飽和溶液的是( )
A.酒精????????????? B.熟石灰????????????? C.二氧化碳????????????? D.硝酸鉀
5.在①碘酒;②糖水;③70%的酒精;④稀硫酸等幾種溶液中,溶劑是同一種物質的是( )
A.①③????????????? B.②④????????????? C.①②③????????????? D.②③④
6.下列防銹措施中,正確的是( )
A.用過的菜刀不用處理????????????? B.給長期放置的鐵鍋涂油
C.用“鍋絲球”刷鋁鍋????????????? D.給自行車鏈條噴漆
7.(秦皇島中考化學)下面物質中,不能用金屬和酸直接反應得到的是( )
A.MgCl2????????????? B.Al2(SO4)3????????????? C.ZnCl2????????????? D.Fe2(SO4)3
8.下列化學反應方程式中,正確的是( )
A.4Fe+3O2![]() 2Fe2O3????????????? B.Fe+2HCl=FeCl2+H2↑
2Fe2O3????????????? B.Fe+2HCl=FeCl2+H2↑
C.3CuSO4+2Fe=Fe2(SO4)3+3Cu????????????? D.Cu+H2SO4=CuSO4+H2↑
9.在相同溫度時,食鹽的飽和溶液和不飽和溶液的溶質質量分數大小關系是( )
A.前者大于后者????????????? B.后者大于前者????????????? C.兩者相等????????????? D.無法比較
10.小雷在探究金屬活動性順序時,將鋅粒放入硫酸銅溶液中,卻發現鋅粒表面有氣體產生,小雷推測該氣體可能是( )
A.氫氣????????????? B.一氧化碳????????????? C.二氧化碳????????????? D.二氧化氮
11.如圖所示,分別向盛有質量相等、質量分數相等的稀鹽酸中加入等質量的鋅片和鐵片,在反應過程中,天平指針指向的變化試( )
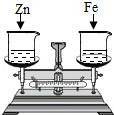
A.向左偏????????????? B.向右偏
C.先向左偏后向右偏????????????? D.先向右偏后向左偏
12.將鐵片放入下列溶液中,溶液的質量會減少的是( )
A.稀鹽酸????????????? B.硝酸銀溶液????????????? C.硫酸亞鐵溶液????????????? D.硫酸鋅溶液
13.夏天戶外野營會看到有人用化學的方法制造“冰袋”,下列可用的物質是( )
A.食鹽????????????? B.熟石灰????????????? C.蔗糖????????????? D.硝酸銨
14.如圖是A、B兩種固體物質的溶解度曲線,下列說法正確的是( )
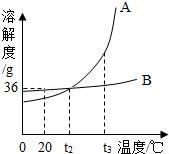
A.A的溶解度大于B的溶解度
B.t1℃時,A、B溶液中溶質的質量分數相等
C.降低溫度能使接近飽和的A溶液變為飽和溶液
D.A中混B,用蒸發結晶的方法提純
15.能區分CaCO3、NaCl、CaO這三種物質的簡單方法是( )
A.稀鹽酸????????????? B.水????????????? C.加強熱????????????? D.CaCl2溶液
16.20℃時,氯化鈉的溶解度為36g.對這句話理解正確的是( )
A.20℃時,136g氯化鈉溶液中含有氯化鈉36g
B.20℃時,100g氯化鈉飽和溶液中含氯化鈉36g
C.20℃時,氯化鈉飽和溶液中水與氯化鈉的質量比為100:36
D.20℃時,將36g氯化鈉溶于100g水中,所得溶液為該溫度下氯化鈉的不飽和溶液
17(秦皇島中考化學).2016年9月23日,臺北故宮院長表示,將移除成龍捐贈的12生肖獸首銅像,如圖所示,獸首的制作材料屬于( )

A.金屬材料????????????? B.合成材料
C.無機非金屬材料????????????? D.復合材料
18.向一定量的鐵粉中逐滴加入稀硫酸至過量,如圖是反應過程中某種物質的質量Y隨加入稀硫酸的質量變化的關系,則Y不可能表示( )
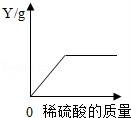
A.消耗鐵粉的質量????????????? B.生成硫酸亞鐵的質量
C.溶液的總質量????????????? D.生成氫氣的質量
19.將X,Y,Z三種金屬分別投入足量的稀硫酸中,只有X,Z能發生反應,并放出氫氣.將Z投入X的硝酸鹽溶液中,有金屬X產生.則X,Y,Z三種金屬的活動性由強到弱的順序為( )
A.Z>Y>X????????????? B.Z>X>Y????????????? C.X>Z>Y????????????? D.Y>Z>X
20.往Cu(NO3)2、Zn(NO3)2的混合溶液中加入一些鐵粉,待反應完成后再過濾,向濾渣中滴加稀鹽酸,無氣泡產生,可能的答案是( )
A.濾紙上有Cu,濾液中有Cu2+、Zn2+、Fe2+
B.濾紙上有Cu,濾液中有Cu2+、Fe2+
C.濾紙上有Cu、Fe,濾液中有Zn2+、Fe2+
D.濾紙上有Cu、Fe,濾液中有Cu2+、Zn2+、Fe2+
二、填空及簡答題(每空1分,共26分)
21.為了配制50g5%的氯化鈉溶液,需進行如下操作:①計算;②用托盤天平稱量 g氯化鈉;③用 (填“10mL”或“50mL”)量筒量取 mL水;④將兩者置于燒杯中,用 (填儀器名稱)攪拌,使氯化鈉溶解.
22.(1)小吳家的鋁壺由于長時間燒水,內有一層水垢(主要含碳酸鈣)在家里可選用 除垢,除垢時間不宜過長的原因是 .
(2)廚房刷洗餐具用到洗滌靈,它的作用是 .
(3)鐵在 條件下容易生銹,表面易生成一種暗紅色的固體,其主要成分的化學式為 .
(4)校園內鐵制車棚易生銹,寫出一種防止其生銹的方法: ;同樣是金屬,為什么金屬鋁露置在空氣中不容易被腐蝕?(寫化學方程式) .
(5)使用鐵鍋有利于人體健康,主要是因為 .
23.在溶質質量分數為20%的KNO3溶液中加入3gKNO3和12g水完全溶解后,所得溶液中溶質的質量分數為 .
24.(秦皇島中考化學)市場上有一種鋅和銅的合金﹣﹣黃銅,外觀似黃金但質地堅硬.
(1)黃銅 (選填“是”或“不是”)金屬材料.
(2)使用黃銅的優點是 .(只寫一點)
(3)不法商販用黃銅制造假黃金首飾,通過加熱可以鑒別,化學方程式為 .
(4)你還可以用 方法鑒別,化學方程式為 .
25.如圖是A、B、C三種固體物質的溶解度曲線圖,請結合圖示回答下列問題:
(1)t1℃時,將20g的A物質加入到50g水中,充分溶解后,所得溶液是 (選填“飽和”或“不飽和”)溶液.
(2)室溫下,將盛有B的飽和溶液的試管(底部有部分固體未溶解)放入盛水的燒杯中,再向燒杯內的水中加入一定量的CaO,并攪拌,試管內可以觀察到的現象是 ,原因是 .
(3)將t1℃時A和C的飽和溶液同時升高到t2℃后,所得溶液中溶質的質量分數的大小關系是 .

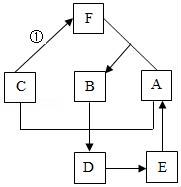
26.A~F是初中常見的物質,A是空氣中的主要成分,B常溫下為液體,它們之間存在如圖所示的轉換關系.
(1)寫出下列物質的化學式:C ;D .
(2)寫出①發生的化學反應方程式 ,此反應屬于 反應.
(3)E轉化為A的原因是 .
三、實驗與探究題(27題,每空1分,28題,每空2分,共24分)
27.河北遷安以鋼鐵為主要產業,某化學興趣小組用如圖a所示裝置探究煉鐵的原理.請回答有關問題:

(1)實驗開始時,應 (選填“先加熱再通CO”或“先通CO再加熱”),目的是 .
(2)試驗結束后,應 (選填“先停止加熱”或“先停止通CO”),目的是 .
(3)玻璃管A中出現的現象為 ;反應方程式為 .
(4)高爐煉鐵中的焦炭也具有還原性,但實際上煉鐵主要利用了CO的性質,其原因是 .焦炭的作用 .
(5)在工業生產中,企業要測定礦石的品味(即主要成分的質量分數),該興趣小組利用如圖b裝置,設計了實驗方案(裝置氣密性良好;赤鐵礦粉中雜質不參與反應;假設赤鐵礦粉樣品中的Fe2O3完全反應);他們通過測定 等數據,再通過計算可以得出赤鐵礦粉樣品中Fe2O3的質量分數.
(6)為防止實驗中尾氣對大氣的污染,請寫出處理尾氣的一種方法 .
28.某實驗小組在探究金屬活動性順序的實驗中,用到的藥品有鐵絲、銅絲、銀絲、稀硫酸和硫酸銅溶液.實驗結束后,該小組的同學對實驗的廢液產生了興趣并進行探究.
【提出問題】廢液中含有什么物質?
(1)認為廢液中一定含有硫酸銅的依據是 .
(2)認為廢液中一定含有硫酸亞鐵的依據是 .
【作出猜想】有的同學認為廢液中還可能含有硫酸.
【實驗驗證】實驗方案是 .還可以通過加入 的方法檢驗.通過分析與實驗,同學們得出廢液中含有硫酸亞鐵、硫酸銅和硫酸.
【拓展應用】
(3)若要將廢液中的溶質全部轉化為硫酸亞鐵,應向廢液中加入過量的 .寫出該反應過程中的一個化學方程式 .
(4)反應完全后,過濾,濾渣中物質為 ,濾液中溶質為硫酸亞鐵.
四、計算應用題(29題5分,30題5分,共10分,解答時要求有必要的文字說明、公式和計算步驟等,只寫最后結果不得分)
29.測出赤鐵礦中氧化鐵的質量分數為70%,現煉鐵廠利用赤鐵礦石3000t.理論上可煉出含鐵98%的生鐵的質量是多少?
30.某課外小組,用大理石與鹽酸反應制取二氧化碳(大理石雜質不與鹽酸反應).甲、乙、丙三同學分別進行實驗,實驗數據如表(燒杯的質量為25.0g).
| 燒杯+鹽酸 | 大理石 | 充分反應后燒杯+剩余物 |
甲 | 75.0g | 13.2g | 83.8g |
乙 | 75.0g | 16.0g | 86.6g |
丙 | 95.0g | 13.2g | 103.8g |
(1) 同學所取的鹽酸與大理石恰好完全反應.
(2)計算大理石中碳酸鈣的質量分數(計算結果精確到0.1%).
(3)計算恰好完全反應的那位同學所得溶液的溶質質量分數.(計算結果精確到0.1%)
秦皇島中考化學參考答案與試題解析
一、選擇題(每小題2分,共40分,每小題只有一個選項符合題意)
1.下列家庭常用物質中,屬于純凈物的是( )
A.黃金????????????? B.食醋????????????? C.蒸餾水????????????? D.紅牛
【考點】純凈物和混合物的判別.
【分析】純凈物由一種物質組成,混合物由兩種或兩種以上的物質組成.
【解答】解:A、家庭常用的黃金是金的合金,屬于純凈物;
B、食醋中含有水和醋酸等物質,屬于混合物;
C、蒸餾水是由一種物質組成的,屬于純凈物;
D、紅牛飲料中含有碳酸、水等物質,屬于混合物.
故選:C.
2.(秦皇島中考化學)下列常見的物質與水混合,能形成溶液的是( )
A.白糖????????????? B.植物油????????????? C.牛奶????????????? D.沙子
【考點】溶液的概念、組成及其特點.
【分析】本題考查溶液的概念,在一定條件下溶質分散到溶劑中形成的是均一穩定的混合物.
【解答】解:A、白糖易溶于水,形成均一、穩定的混合物,屬于溶液,故A正確;
B、植物油不溶于水,與水混合形成的是乳濁液,不均一、不穩定,不屬于溶液,故B錯;
B、牛奶不溶于水,不能和水形成均一、穩定的混合物,即不能夠形成溶液,故C錯;
D、沙子不溶于水,與水混合形成的是懸濁液,不均一、不穩定,故D錯.
故選A.
3.下列物質中,不屬于合金的是( )
A.不銹鋼????????????? B.純鐵????????????? C.硬鋁????????????? D.生鐵
【考點】合金與合金的性質.
【分析】合金是指在一種金屬中加熱熔合其它金屬或非金屬而形成的具有金屬特性的物質;合金具有以下特點:①一定是混合物;②合金中至少有一種金屬等.
【解答】解:A、不銹鋼屬于鐵的合金,故選項錯誤.
B、純鐵是純金屬,不屬于合金,故選項正確.
C、硬鋁屬于鋁的合金,故選項錯誤.
D、生鐵屬于鐵的合金,故選項錯誤.
故選:B.
4.下列物質不可能與水形成飽和溶液的是( )
A.酒精????????????? B.熟石灰????????????? C.二氧化碳????????????? D.硝酸鉀
【考點】固體溶解度的影響因素;溶液、溶質和溶劑的相互關系與判斷;氣體溶解度的影響因素.
【分析】常見的物質中不可能與水形成飽和溶液的應該是可以無限制的溶于水中的物質,屬特殊的物質,所給的物質中只有酒精具備該特征.
【解答】解:不能形成飽和溶液的物質,其特征應該是可以無限制溶解的物質,酒精能夠無限制的溶解在水中,所以不能形成飽和溶液.
故選A.
5.在①碘酒;②糖水;③70%的酒精;④稀硫酸等幾種溶液中,溶劑是同一種物質的是( )
A.①③????????????? B.②④????????????? C.①②③????????????? D.②③④
【考點】溶液的概念、組成及其特點.
【分析】(1)溶質是被溶解的物質;
(2)溶劑是能溶解其他物質的物質.
【解答】解:
①碘酒溶液是碘溶于酒精形成的;故溶劑是酒精
②糖水溶液是糖溶于水形成的;故溶劑是水
③70%的酒精溶液是酒精溶于水形成的;故溶劑是水
④稀硫酸是硫酸溶于水形成的;故溶劑是水
故選D
6.(秦皇島中考化學)下列防銹措施中,正確的是( )
A.用過的菜刀不用處理????????????? B.給長期放置的鐵鍋涂油
C.用“鍋絲球”刷鋁鍋????????????? D.給自行車鏈條噴漆
【考點】金屬銹蝕的條件及其防護;金屬的化學性質.
【分析】根據鐵銹蝕的條件是鐵與水和氧氣并存,防銹的方法就是破壞鐵生銹的條件,據此解答.
【解答】解:A、用過的菜刀不處理容易生銹,錯誤;
B、給長期放置的鐵鍋涂油,能防止生銹,正確;
C、用“鍋絲球”刷鋁鍋會破壞表面的保護膜,錯誤;
D、自行車鏈條防銹不宜噴漆,錯誤;
故選B.
7.下面物質中,不能用金屬和酸直接反應得到的是( )
A.MgCl2????????????? B.Al2(SO4)3????????????? C.ZnCl2????????????? D.Fe2(SO4)3
【考點】金屬的化學性質.
【分析】根據已有的金屬的性質進行分析解答即可.
【解答】解:A、鎂能與鹽酸直接反應生成氯化鎂;
B、鋁能與稀硫酸反應生成硫酸鋁;
C、鋅能與稀鹽酸直接反應生成氯化鋅;
D、鐵與稀硫酸反應生成的是硫酸亞鐵,不是硫酸鐵;
故選D.
8.下列化學反應方程式中,正確的是( )
A.4Fe+3O2![]() 2Fe2O3????????????? B.Fe+2HCl=FeCl2+H2↑
2Fe2O3????????????? B.Fe+2HCl=FeCl2+H2↑
C.3CuSO4+2Fe=Fe2(SO4)3+3Cu????????????? D.Cu+H2SO4=CuSO4+H2↑
【考點】書寫化學方程式、.
【分析】根據化學方程式判斷正誤的方法需考慮:應用的原理是否正確;化學式書寫是否正確;是否配平;反應條件是否正確;↑和↓的標注是否正確.
【解答】解:A、鐵和氧氣在點燃的條件下生成四氧化三鐵,化學方程式為:3Fe+2O2![]() Fe3O4,故A錯誤;
Fe3O4,故A錯誤;
B、鐵和鹽酸反應生成氯化亞鐵和氫氣,化學方程式為:Fe+2HCl=FeCl2+H2↑,故B正確;
C、鐵和硫酸銅反應生成硫酸亞鐵和銅,化學方程式為:CuSO4+Fe=FeSO4+Cu,故C錯誤;
D、銅排在氫之后,不會與與酸反應生成氫氣,故D錯誤.
故選:B.
9.在相同溫度時,食鹽的飽和溶液和不飽和溶液的溶質質量分數大小關系是( )
A.前者大于后者????????????? B.后者大于前者????????????? C.兩者相等????????????? D.無法比較
【考點】有關溶質質量分數的簡單計算;溶質的質量分數、溶解性和溶解度的關系.
【分析】根據飽和溶液和不飽和溶液的定義進行分析.
【解答】解:在一定溫度下,還能溶解某種溶質的溶液叫該物質的不飽和溶液,不能繼續溶解某物質的溶液,叫該物質的飽和溶液,
飽和氯化鈉溶液中氯化鈉的量達到了最大溶解量,不飽和氯化鈉溶液中,氯化鈉的溶解沒有達到氯化鈉的最大溶解量,所以前者質量分數大,
故選A.
10.(秦皇島中考化學)小雷在探究金屬活動性順序時,將鋅粒放入硫酸銅溶液中,卻發現鋅粒表面有氣體產生,小雷推測該氣體可能是( )
A.氫氣????????????? B.一氧化碳????????????? C.二氧化碳????????????? D.二氧化氮
【考點】金屬的化學性質.
【分析】根據質量守恒定律:化學前后元素的種類不變,進行分析判斷即可.
【解答】解:根據質量守恒定律:化學反應前后元素的種類不變可知,反應物是Zn、CuSO4,還可能有溶劑H2O,不含碳元素,不可能產生二氧化碳、一氧化碳;該氣體可能是氫氣.
A、由質量守恒定律:化學反應前后元素的種類不變可知,反應物是Zn、CuSO4,還可能有溶劑H2O,則該氣體可能是氫氣,故選項正確.
B、反應物中不含有碳元素,生成物中不可能有一氧化碳,故選項錯誤.
C、反應物中不含有碳元素,生成物中不可能有二氧化碳,故選項錯誤.
D、反應物中不含有氮元素,生成物中不可能有二氧化氮,故選項錯誤.
故選A
11.如圖所示,分別向盛有質量相等、質量分數相等的稀鹽酸中加入等質量的鋅片和鐵片,在反應過程中,天平指針指向的變化試( )
A.向左偏????????????? B.向右偏
C.先向左偏后向右偏????????????? D.先向右偏后向左偏
【考點】金屬的化學性質.
【分析】根據金屬與酸反應放出氫氣的快慢和金屬與酸反應放出氫氣的多少,判斷變化過程中天平指針會如何變化.
【解答】解:天平的指針總是偏向質量大的一方;在兩邊的金屬都沒反應完時,由于鋅的活動性比鐵強,鋅與稀鹽酸反應放出氫氣的速率大于鐵,因此,此段時間內,加鐵一邊因放出氫氣的速度慢而質量大,天平指針偏向加鐵一邊即偏向圖中的右邊;當金屬鋅完全反應后,圖中天平左邊的質量不再減小,而鐵繼續與稀鹽酸反應,最終放出氫氣的多少將決定天平指針的偏轉,根據金屬與酸反應放出氫氣的質量=![]() ×金屬質量,可判斷兩種金屬都完全反應后,鐵與鹽酸放出氫氣的質量大于等質量的鋅與鹽酸反應放出氫氣的質量,所以,天平左邊加鋅的一端因放出氫氣質量少而質量大于加鐵的右邊,天平指針最終將偏向加鋅的左邊;
×金屬質量,可判斷兩種金屬都完全反應后,鐵與鹽酸放出氫氣的質量大于等質量的鋅與鹽酸反應放出氫氣的質量,所以,天平左邊加鋅的一端因放出氫氣質量少而質量大于加鐵的右邊,天平指針最終將偏向加鋅的左邊;
綜上所述,天平指針就先右偏后向左;
故選:D.
12.(秦皇島中考化學)將鐵片放入下列溶液中,溶液的質量會減少的是( )
A.稀鹽酸????????????? B.硝酸銀溶液????????????? C.硫酸亞鐵溶液????????????? D.硫酸鋅溶液
【考點】金屬的化學性質.
【分析】根據金屬的化學性質及各物質發生化學反應時的質量比進行分析解答.在金屬活動性順序表中,氫前面的金屬能和常見的酸反生反應置,位于前面的金屬能把排在它后面的金屬從其鹽溶液中轉換出來.首先確定把鐵加入溶液中是否發生反應,如果不反應,則溶液的質量保持不變;如果反應,再看反應后生成的溶質的質量是否增大或減小,從而判斷出溶液的質量的變化.
【解答】解:A、鐵與稀鹽酸能反應,生成氫氣和氯化亞鐵而使溶液質量增加,其原因是:由反應的化學方程式:Fe+2HCl═FeCl2+H2↑,可知56gFe反應溶液增加(56﹣2)=54g,所以溶液質量增加,故A錯誤;
B、鐵與硝酸銀溶液能反應,生成硝酸亞鐵溶液和銀而使溶液質量減少,其原因是:由反應的化學方程式:Fe+2AgNO3═Fe(NO3)2+2Ag,可知56gFe反應生成216g銀,所以溶液質量減少,故B正確;
C、鐵與硫酸亞鐵不能反應,所以溶液質量不會變化,故C錯誤;
D、鐵的位置排在鋅的后面,鐵與硫酸鋅溶液不發生反應,則溶液的質量不變,故D錯誤.
故選:B.
13.夏天戶外野營會看到有人用化學的方法制造“冰袋”,下列可用的物質是( )
A.食鹽????????????? B.熟石灰????????????? C.蔗糖????????????? D.硝酸銨
【考點】溶解時的吸熱或放熱現象.
【分析】物質溶于水制得的冰袋可用高燒病人降溫,說明該物質溶于水吸熱,使溶液的溫度降低,據此進行分析判斷.
【解答】解:A、食鹽溶于水溫度變化不大,不能制得冰袋可用高燒病人降溫,故選項錯誤.
B、熟石灰溶于水不放熱,不能制得冰袋可用高燒病人降溫,故選項錯誤.
C、蔗糖溶于水溫度變化不大,不能制得冰袋可用高燒病人降溫,故選項錯誤.
D、硝酸銨固體溶于水吸熱,溫度降低,溶于水制得的冰袋可用高燒病人降溫,故選項正確.
故選:D.
14.如圖是A、B兩種固體物質的溶解度曲線,下列說法正確的是( )
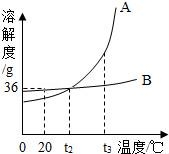
A.A的溶解度大于B的溶解度
B.t1℃時,A、B溶液中溶質的質量分數相等
C.降低溫度能使接近飽和的A溶液變為飽和溶液
D.A中混B,用蒸發結晶的方法提純
【考點】固體溶解度曲線及其作用;結晶的原理、方法及其應用;飽和溶液和不飽和溶液相互轉變的方法.
【分析】根據固體的溶解度曲線可以:①查出某物質在一定溫度下的溶解度,從而確定物質的溶解性,②比較不同物質在同一溫度下的溶解度大小,從而判斷飽和溶液中溶質的質量分數的大小,③判斷物質的溶解度隨溫度變化的變化情況,從而判斷通過降溫結晶還是蒸發結晶的方法達到提純物質的目的.
【解答】解:A、在比較物質的溶解度時,需要指明溫度,故A錯誤;
B、t1℃時,A、B物質的溶解度相等,飽和溶液中溶質的質量分數相等,故B錯誤;
C、A物質的溶解度隨溫度的升高而增大,所以降低溫度能使接近飽和的A溶液變為飽和溶液,故C正確;
D、A物質的溶解度受溫度的一些變化一些較大,所以A中混B,用降溫結晶的方法提純,故D錯誤.
故選:C.
15.(秦皇島中考化學)能區分CaCO3、NaCl、CaO這三種物質的簡單方法是( )
A.稀鹽酸????????????? B.水????????????? C.加強熱????????????? D.CaCl2溶液
【考點】酸、堿、鹽的鑒別.
【分析】根據已有的物質的性質差異進行分析解答即可,鑒別時需要出現不同的實驗現象.
【解答】解:A、稀鹽酸與碳酸鈣反應產生二氧化碳氣體,與氯化鈉混合氯化鈉溶解,與氧化鈣混合氧化鈣溶解掉,不能鑒別;
B、碳酸鈣不溶于水,氯化鈉能溶于水,氧化鈣與水混合放熱現象明顯,方法簡單;
C、加強熱只有碳酸鈣可能產生氣體,而氯化鈉和氧化鈣都沒有現象,不能鑒別;
D、氯化鈣溶液與碳酸鈣混合不溶解,與氯化鈉混合氯化鈉溶解,與氧化鈣混合有不溶物,不能鑒別;
故選B.
16.20℃時,氯化鈉的溶解度為36g.對這句話理解正確的是( )
A.20℃時,136g氯化鈉溶液中含有氯化鈉36g
B.20℃時,100g氯化鈉飽和溶液中含氯化鈉36g
C.20℃時,氯化鈉飽和溶液中水與氯化鈉的質量比為100:36
D.20℃時,將36g氯化鈉溶于100g水中,所得溶液為該溫度下氯化鈉的不飽和溶液
【考點】固體溶解度的概念.
【分析】溶解度是在一定溫度下,某固體溶質在100g溶劑里達到飽和狀態所溶解的溶質質量;溶解度定義中的四要素:一定溫度、100g溶劑、溶液達到飽和狀態、溶解的質量及單位克.
【解答】解:20℃時,氯化鈉的溶解度為36g,其涵義是20℃時,100g水中最多溶解36g氯化鈉,溶液達到飽和狀態.
A、20℃時,136g氯化鈉飽和溶液中含有氯化鈉36g,故選項說法錯誤.
B、20℃時,136g氯化鈉飽和溶液中含有氯化鈉36g,故選項說法錯誤.
C、20℃時,氯化鈉飽和溶液中水與氯化鈉的質量比為100g:36g=100:36,故選項說法正確.
D、20℃時,將36g氯化鈉溶于100g水中,所得溶液為該溫度下氯化鈉的飽和溶液,故選項說法錯誤.
故選:C.
17.2016年9月23日,臺北故宮院長表示,將移除成龍捐贈的12生肖獸首銅像,如圖所示,獸首的制作材料屬于( )

A.金屬材料????????????? B.合成材料
C.無機非金屬材料????????????? D.復合材料
【考點】金屬材料及其應用.
【分析】根據已有的物質的材料類別進行分析解答即可,銅屬于金屬材料.
【解答】解:銅屬于金屬材料,故選A.
18(秦皇島中考化學).向一定量的鐵粉中逐滴加入稀硫酸至過量,如圖是反應過程中某種物質的質量Y隨加入稀硫酸的質量變化的關系,則Y不可能表示( )
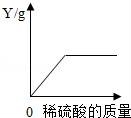
A.消耗鐵粉的質量????????????? B.生成硫酸亞鐵的質量
C.溶液的總質量????????????? D.生成氫氣的質量
【考點】金屬活動性順序及其應用;酸的化學性質;根據化學反應方程式的計算.
【分析】鐵可以與硫酸反應生成硫酸亞鐵和氫氣,隨著硫酸的加入,鐵粉逐漸被消耗盡,然后根據反應的事實完成此題.
【解答】解:A、向一定量的鐵粉中逐滴加入稀硫酸至過量,鐵粉將會被全部消耗盡,也就是消耗鐵粉的質量逐漸增多,最后不變,故A正確;
B、鐵可以與硫酸反應生成硫酸亞鐵和氫氣,鐵粉消耗盡時,硫酸亞鐵的質量不再改變,故B正確;
C、鐵可以與硫酸反應生成硫酸亞鐵和氫氣,隨著鐵的消耗,溶液質量不斷增加,當鐵粉消耗盡時,隨著硫酸不斷的滴加,溶液的質量繼續增加,但是圖象中溶液的總質量不再改變,故C錯誤;
D、鐵可以與硫酸反應生成硫酸亞鐵和氫氣,隨著鐵的消耗,氫氣的質量不斷增加,當鐵粉消耗盡時,氫氣的質量不再改變,故D正確.
故選C.
19.將X,Y,Z三種金屬分別投入足量的稀硫酸中,只有X,Z能發生反應,并放出氫氣.將Z投入X的硝酸鹽溶液中,有金屬X產生.則X,Y,Z三種金屬的活動性由強到弱的順序為( )
A.Z>Y>X????????????? B.Z>X>Y????????????? C.X>Z>Y????????????? D.Y>Z>X
【考點】金屬活動性順序及其應用.
【分析】因為“X,Z能發生反應,并放出氫氣”,說明X、Z的金屬活動性大于Y;“將Z投入X的硝酸鹽溶液中,有金屬X產生”,說明Z>X,則可知X,Y,Z三種金屬的活動性由強到弱的順序.
【解答】解:由題意“X,Z能發生反應,并放出氫氣”,說明X、Z的金屬活動性大于Y;“將Z投入X的硝酸鹽溶液中,有金屬X產生”,說明Z>X,則可知X,Y,Z三種金屬的活動性由強到弱的順序為:Z>X>Y.
故選B.
20.往Cu(NO3)2、Zn(NO3)2的混合溶液中加入一些鐵粉,待反應完成后再過濾,向濾渣中滴加稀鹽酸,無氣泡產生,可能的答案是( )
A.濾紙上有Cu,濾液中有Cu2+、Zn2+、Fe2+
B.濾紙上有Cu,濾液中有Cu2+、Fe2+
C.濾紙上有Cu、Fe,濾液中有Zn2+、Fe2+
D.濾紙上有Cu、Fe,濾液中有Cu2+、Zn2+、Fe2+
【考點】金屬的化學性質.
【分析】根據金屬活動性順序鋅>鐵>銅,向含有Cu(NO3)2、Zn(NO3)2的混合溶液中加入一定量的鐵粉,鐵粉會置換出硝酸銅中的銅,不會置換出硝酸鋅中的鋅,過濾,向濾渣中滴加稀鹽酸,無氣泡產生,說明濾渣金屬中不含有鐵,一定含有銅進行分析.
【解答】解:金屬活動性順序鋅>鐵>銅,向含有Cu(NO3)2、Zn(NO3)2的混合溶液中加入一定量的鐵粉,鐵粉會置換出硝酸銅中的銅,不會置換出硝酸鋅中的鋅,過濾,向濾渣中滴加稀鹽酸,無氣泡產生,說明濾渣金屬中不含有鐵,一定含有銅,所以
A、濾紙上有Cu,濾液中有Cu2+、Zn2+、Fe2+,故A正確;
B、濾液中一定存在鋅離子,故B錯誤;
C、濾渣中一定不含鐵,故C錯誤;
D、濾渣中一定不含鐵,故D錯誤.
故選:A.
二、填空及簡答題(每空1分,共26分)
21.(秦皇島中考化學)為了配制50g5%的氯化鈉溶液,需進行如下操作:①計算;②用托盤天平稱量 2.5 g氯化鈉;③用 50 (填“10mL”或“50mL”)量筒量取 47.5 mL水;④將兩者置于燒杯中,用 玻璃棒 (填儀器名稱)攪拌,使氯化鈉溶解.
【考點】一定溶質質量分數的溶液的配制.
【分析】根據配制溶質質量分數一定的溶液的基本步驟,利用溶質質量=溶液質量×溶質的質量分數,可根據溶液的質量和溶質的質量分數計算配制溶液所需要的溶質的質量;再根據溶劑質量=溶液質量﹣溶質質量即可求得蒸餾水的質量和體積;進行分析解答.
【解答】解:配制一定質量分數的溶液的步驟:計算、稱量(量取)、溶解、裝瓶貼簽.
溶質質量=溶液質量×溶質的質量分數,50g5%的氯化鈉溶液,需氯化鈉的質量=50g×5%=2.5g;溶劑質量=溶液質量﹣溶質質量,則所需蒸餾水的質量=50g﹣2.5g=47.5g;水的密度為1g/cm3,則根據V=![]() =
=![]() =47.5cm3=47.5mL,應選用50mL的量筒.將兩者置于燒杯中,用 玻璃棒攪拌,使氯化鈉溶解.
=47.5cm3=47.5mL,應選用50mL的量筒.將兩者置于燒杯中,用 玻璃棒攪拌,使氯化鈉溶解.
故答案為:2.5;50mL;47.5;玻璃棒
22.(1)小吳家的鋁壺由于長時間燒水,內有一層水垢(主要含碳酸鈣)在家里可選用 食醋 除垢,除垢時間不宜過長的原因是 防止過量的食醋腐蝕鋁壺 .
(2)廚房刷洗餐具用到洗滌靈,它的作用是 做乳化劑 .
(3)鐵在 潮濕 條件下容易生銹,表面易生成一種暗紅色的固體,其主要成分的化學式為 Fe2O3 .
(4)校園內鐵制車棚易生銹,寫出一種防止其生銹的方法: 在車棚表面噴漆 ;同樣是金屬,為什么金屬鋁露置在空氣中不容易被腐蝕?(寫化學方程式) 4Al+3O2═2Al2O3 .
(5)使用鐵鍋有利于人體健康,主要是因為 能增加人體中的鐵元素 .
【考點】鹽的化學性質;乳化現象與乳化作用;金屬銹蝕的條件及其防護;鐵銹的主要成分;書寫化學方程式、.
【分析】(1)碳酸鈣可以和酸反應,所以利用酸堿中和反應除去水垢,但是鋁為活潑金屬也可以和酸反應,可以據此解答.
(2)利用洗潔精的乳化作用,可解釋其去除油污的原理;能將油污以細小的液滴均勻分散到水中形成乳濁液的現象叫乳化作用.
(3)鐵在潮濕的空氣中與水和氧氣共同作用而生銹,主要成分是三氧化二鐵.
(4)根據生銹的條件考慮防銹的措施,根據鋁與氧氣反應的生成物考慮本題.
(5)鐵是人體所必需的微量元素,是血紅蛋白的主要成分,據此進行分析解答.
【解答】解:(1)碳酸鈣可以和酸反應,所以可以用廚房中的食醋來除去水垢,但是鋁為活潑金屬也可以和食醋中的醋酸反應,所以不能長時間浸泡,否則會腐蝕鋁壺.
故答案為:食醋;防止過量的食醋腐蝕鋁壺 (或過量的酸與鋁發生反應).
(2)洗潔精具有乳化作用,能使油污與水形成相對穩定的乳濁液而洗去油污,所以洗滌靈起到的作用是做乳化劑.
故答案為:做乳化劑.
(3)鐵在潮濕的空氣中與水和氧氣共同作用而生銹,主要成分是三氧化二鐵,可用化學式Fe2O3表示.
故答案為:潮濕;Fe2O3.
(4)鐵生銹的條件是與氧氣和水共同接觸,只要將鐵制品與水或氧氣隔絕就行了,所以在鐵制品表面噴漆即可;由于鋁與氧氣反應生成一層致密的氧化膜,保護了內部的鋁,化學方程式為:4Al+3O2═2Al2O3.
故答案為:在車棚表面噴漆;4Al+3O2═2Al2O3.
(5)鐵是血紅蛋白的主要成分,使用鐵鍋能增加人體中的鐵元素,滿足人體需要.
故答案為:能增加人體中的鐵元素.
23.(秦皇島中考化學)在溶質質量分數為20%的KNO3溶液中加入3gKNO3和12g水完全溶解后,所得溶液中溶質的質量分數為 20% .
【考點】有關溶質質量分數的簡單計算.
【分析】在溶質質量分數為20%的KNO3溶液中加入3gKNO3和12g水完全溶解后,可看做是在溶質質量分數為20%的KNO3溶液中加入了3gKNO3溶于12g水形成的溶液,根據溶質質量分數=![]() 100%,進行分析解答.
100%,進行分析解答.
【解答】解:在溶質質量分數為20%的KNO3溶液中加入3gKNO3和12g水完全溶解后,可看做是在溶質質量分數為20%的KNO3溶液中加入了3gKNO3溶于12g水形成的溶液;
3gKNO3溶于12g水形成的溶液中溶液中溶質的質量分數為![]() 100%=20%;則在溶質質量分數為20%的KNO3溶液中加入20%的硝酸鉀溶液完全溶解后,所得溶液中溶質的質量分數仍為20%.
100%=20%;則在溶質質量分數為20%的KNO3溶液中加入20%的硝酸鉀溶液完全溶解后,所得溶液中溶質的質量分數仍為20%.
故答案為:20%.
24.市場上有一種鋅和銅的合金﹣﹣黃銅,外觀似黃金但質地堅硬.
(1)黃銅 是 (選填“是”或“不是”)金屬材料.
(2)使用黃銅的優點是 硬度大 .(只寫一點)
(3)不法商販用黃銅制造假黃金首飾,通過加熱可以鑒別,化學方程式為 2Cu+O2![]() 2CuO .
2CuO .
(4)你還可以用 加入稀鹽酸 方法鑒別,化學方程式為 Zn+2HCl═ZnCl2+H2↑ .
【考點】金屬材料及其應用;金屬的化學性質;書寫化學方程式、.
【分析】根據已有的合金的性質和特點、成分以及金屬的性質進行分析解答即可
【解答】解:(1)黃銅是銅的合金,屬于金屬材料,故填:是;
(2)黃銅的硬度比純金屬大,故填:硬度大;
(3)加熱則黃銅中的銅能與氧氣反應生成氧化銅,故填:2Cu+O2![]() 2CuO;
2CuO;
(4)黃銅中的鋅能與鹽酸反應生成氯化鋅和氫氣,故可以加入稀鹽酸鑒別,故填:加入稀鹽酸;Zn+2HCl═ZnCl2+H2↑.
25.如圖是A、B、C三種固體物質的溶解度曲線圖,請結合圖示回答下列問題:
(1)t1℃時,將20g的A物質加入到50g水中,充分溶解后,所得溶液是 飽和 (選填“飽和”或“不飽和”)溶液.
(2)室溫下,將盛有B的飽和溶液的試管(底部有部分固體未溶解)放入盛水的燒杯中,再向燒杯內的水中加入一定量的CaO,并攪拌,試管內可以觀察到的現象是 固體逐漸溶解并消失 ,原因是 氧化鈣與水反應放出熱量,B的溶解度隨溫度升高而增大 .
(3)將t1℃時A和C的飽和溶液同時升高到t2℃后,所得溶液中溶質的質量分數的大小關系是 A<C .

【考點】(秦皇島中考化學)固體溶解度曲線及其作用;溶質的質量分數、溶解性和溶解度的關系;生石灰的性質與用途.
【分析】(1)根據溶解度曲線可知,t1℃時,A的溶解度為40 g,則在該溫度下,50 g水中最多溶解20 g A物質,將20 g A物質加入到50 g水中,所得溶液為飽和溶液;
(2)氧化鈣溶于水時放出熱量,B物質的溶解度增大,則剩余的固體會溶解并消失;
(3)升高溫度時,C物質的溶解度減小,有晶體析出,溶質質量分數減小,A物質的溶解度增大,溶液變為不飽和溶液,但溶質質量分數不變,并結合飽和溶液中溶質的質量分數計算方法解答.
【解答】解:
(1)t1℃時,A的溶解度為40 g,既則在該溫度下,100 g水中最多溶解40 g A物質,則50g水中最多溶解20g的A,所以將20 g A物質加入到50 g水中,恰好為飽和溶液;
(2)氧化鈣溶于水時放出熱量,而B的溶解度隨溫度升高而增大,B物質的溶解度增大,則剩余的固體會逐漸溶解并消失;
(3)升高溫度時,C物質的溶解度減小,有晶體析出,溶質質量分數減小,A物質的溶解度增大,溶液變為不飽和溶液,但溶質質量分數不變,飽和時質量分數的計算式![]() ×100%,即飽和溶液中溶解度大則溶質的質量分數大,而升溫后C的 溶解度大于升溫前A的溶解度,故所得溶液的溶質質量分數A<C;
×100%,即飽和溶液中溶解度大則溶質的質量分數大,而升溫后C的 溶解度大于升溫前A的溶解度,故所得溶液的溶質質量分數A<C;
故答案為:
(1)飽和; (2)固體逐漸溶解并消失;氧化鈣與水反應放出熱量,B的溶解度隨溫度升高而增大;(3)A<C.
26.A~F是初中常見的物質,A是空氣中的主要成分,B常溫下為液體,它們之間存在如圖所示的轉換關系.
(1)寫出下列物質的化學式:C Fe ;D Fe 2O3 .
(2)寫出①發生的化學反應方程式 Fe+2HCl=FeCl2+H2↑ ,此反應屬于 置換 反應.
(3)E轉化為A的原因是 植物的光合作用 .
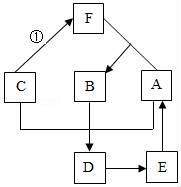
【考點】物質的鑒別、推斷;反應類型的判定;書寫化學方程式、.
【分析】A~F是初中常見的物質,A是空氣中的主要成分,B常溫下為液體,它們之間存在如圖所示的轉換關系,可判斷A為氧氣,B為水,F為氫氣,則①可以使較活潑金屬如鐵和鹽酸反應生成氯化鐵和氫氣,于是C可為鐵,水、氧氣和金屬鐵共同作用生成鐵銹氧化鐵,于是D可以為氧化鐵,氧化鐵與碳或一氧化碳高溫條件下生成鐵和二氧化碳,E可以是二氧化碳,二氧化碳通過光合作用可以轉化為氧氣A,將以上推導代入題中表格合理即可.
【解答】解:A是空氣中的主要成分,B常溫下為液體,它們之間存在如圖所示的轉換關系,可判斷A為氧氣,B為水,F為氫氣,則①可以使較活潑金屬如鐵和鹽酸反應生成氯化鐵和氫氣,于是C可為鐵,水、氧氣和金屬鐵共同作用生成鐵銹氧化鐵,于是D可以為氧化鐵,氧化鐵與碳或一氧化碳高溫條件下生成鐵和二氧化碳,E可以是二氧化碳,二氧化碳通過光合作用可以轉化為氧氣A,將以上推導代入題中表格合理.所以,
(1)C的化學式:Fe;D的化學式:Fe 2O3.
(2)①發生的化學反應方程式:Fe+2HCl=FeCl2+H2↑.,此反應是單質與化合物反應生成另一種單質和化合物,屬于置換反應.
(3)二氧化碳通過光合作用可以轉化為氧氣,E轉化為A的原因是植物的光合作用.
三、(秦皇島中考化學)實驗與探究題(27題,每空1分,28題,每空2分,共24分)
27.河北遷安以鋼鐵為主要產業,某化學興趣小組用如圖a所示裝置探究煉鐵的原理.請回答有關問題:
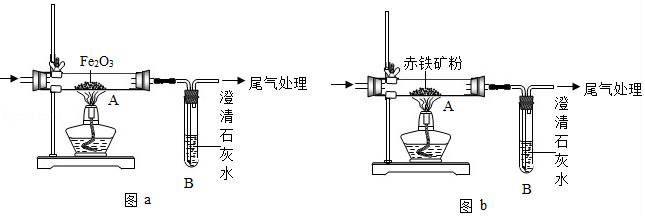
(1)實驗開始時,應 先加熱再通CO (選填“先加熱再通CO”或“先通CO再加熱”),目的是 排凈玻璃管中的空氣,防止一氧化碳與空氣混合發生爆炸 .
(2)試驗結束后,應 先停止加熱 (選填“先停止加熱”或“先停止通CO”),目的是 防止再次被氧化灼熱的鐵 .
(3)玻璃管A中出現的現象為 紅色粉末變黑 ;反應方程式為 3CO+Fe2O3![]() 2Fe+3CO2 .
2Fe+3CO2 .
(4)高爐煉鐵中的焦炭也具有還原性,但實際上煉鐵主要利用了CO的性質,其原因是 一氧化碳具有流動性,能與鐵礦石充分接觸 .焦炭的作用 提供熱量、產生一氧化碳 .
(5)在工業生產中,企業要測定礦石的品味(即主要成分的質量分數),該興趣小組利用如圖b裝置,設計了實驗方案(裝置氣密性良好;赤鐵礦粉中雜質不參與反應;假設赤鐵礦粉樣品中的Fe2O3完全反應);他們通過測定 反應前后玻璃管中固體質量的變化 等數據,再通過計算可以得出赤鐵礦粉樣品中Fe2O3的質量分數.
(6)為防止實驗中尾氣對大氣的污染,請寫出處理尾氣的一種方法 在裝置的末端加一個燃著的酒精燈 .
【考點】一氧化碳還原氧化鐵;書寫化學方程式、.
【分析】(1)根據一氧化碳易可燃,容易發生爆炸考慮;
(2)根據灼熱的鐵能與氧氣反應分析回答;
(3)根據在高溫條件下一氧化碳與氧化鐵的反應分析回答;
(4)根據一氧化碳是氣體能與鐵礦石成分接觸和碳的性質分析回答;
(5)根據在高溫條件下一氧化碳與氧化鐵的反應分析回答;
(6)根據尾氣中含有一氧化碳有毒能污染空氣分析回答.
【解答】解:(1)因為一氧化碳具有可燃性,能和氧氣混合在點燃的條件下會發生爆炸,實驗開始時,應先加熱再通CO,目的是排凈玻璃管中的空氣,防止一氧化碳與空氣混合發生爆炸.
(2)試驗結束后,應先停止加熱,目的是防止再次被氧化灼熱的鐵.
(3)紅色的氧化鐵和一氧化碳在高溫條件下反應能生成鐵和二氧化碳,所以玻璃管A中出現的現象是紅色粉末變黑,其化學方程式為:3CO+Fe2O3![]() 2Fe+3CO2;
2Fe+3CO2;
(4)(秦皇島中考化學)高爐煉鐵中的焦炭也具有還原性,但實際上煉鐵主要利用了CO的性質,其原因是一氧化碳具有流動性,能與鐵礦石充分接觸.由于談成分燃燒生成了二氧化碳,放出了大量的熱,二氧化碳能與碳反應生成了一氧化碳,所以焦炭的作用提供熱量、產生一氧化碳.
(5)在工業生產中,企業要測定礦石的品味(即主要成分的質量分數),該興趣小組利用如圖b裝置,設計了實驗方案(裝置氣密性良好;赤鐵礦粉中雜質不參與反應;假設赤鐵礦粉樣品中的Fe2O3完全反應);他們通過測定反應前后玻璃管中固體質量的變化等數據,再通過計算可以得出赤鐵礦粉樣品中Fe2O3的質量分數.
(6)為防止實驗中尾氣對大氣的污染,處理尾氣的一種方法是:在裝置的末端加一個燃著的酒精燈.
故答案為:
(1)先通CO再加熱;排凈玻璃管中的空氣,防止一氧化碳與空氣混合發生爆炸;
(2)先停止加熱,防止再次被氧化灼熱的鐵
(3)紅色粉末變黑;3CO+Fe2O3![]() 2Fe+3CO2;
2Fe+3CO2;
(4)一氧化碳具有流動性,能與鐵礦石充分接觸,提供熱量、產生一氧化碳;
(5)反應前后玻璃管中固體質量的變化;
(6)在裝置的末端加一個燃著的酒精燈.
28.某實驗小組在探究金屬活動性順序的實驗中,用到的藥品有鐵絲、銅絲、銀絲、稀硫酸和硫酸銅溶液.實驗結束后,該小組的同學對實驗的廢液產生了興趣并進行探究.
【提出問題】廢液中含有什么物質?
(1)認為廢液中一定含有硫酸銅的依據是 溶液顯藍色 .
(2)認為廢液中一定含有硫酸亞鐵的依據是 鐵絲與稀硫酸反應生成硫酸亞鐵 .
【作出猜想】有的同學認為廢液中還可能含有硫酸.
【實驗驗證】實驗方案是 取少量的廢液于試管中,加入鐵粉或,有氣泡冒出證明含有硫酸 .還可以通過加入 碳酸鈉 的方法檢驗.通過分析與實驗,同學們得出廢液中含有硫酸亞鐵、硫酸銅和硫酸.
【拓展應用】
(3)若要將廢液中的溶質全部轉化為硫酸亞鐵,應向廢液中加入過量的 鐵片 .寫出該反應過程中的一個化學方程式 Fe+H2SO4=FeSO4+H2↑ .
(4)反應完全后,過濾,濾渣中物質為 鐵和銅 ,濾液中溶質為硫酸亞鐵.
【考點】實驗探究物質的組成成分以及含量;金屬的化學性質;書寫化學方程式、.
【分析】【提出問題】(1)硫酸銅溶于水后顯示特定的顏色,所以根據它的顏色來進行判斷;
(2)鐵的活動性在這三種金屬中活動性最強,可以據此作出判斷;
【實驗驗證】根據氫離子的驗證方法分析;
【拓展應用】(1)鐵可以和硫酸及硫酸銅反應生成硫酸亞鐵;
(2)鐵和硫酸銅置換出來,生成了銅,當然也得考慮的到鐵是過量的.
【解答】解:【提出問題】(1)硫酸銅溶于水的到藍色溶液,所以該學生的得出含有硫酸銅是因為看到了溶液呈藍色;
(2)根據金屬活動性順序及其應用,鐵的活動性最強,所以發生的反應為:鐵和稀硫酸反應能夠生成硫酸亞鐵,鐵和硫酸銅反應也能生成硫酸亞鐵,所以可以判斷一定含有硫酸亞鐵;
【實驗驗證】驗證硫酸的存在,可以取少量的廢液于試管中,加入鐵粉或(碳酸鈉/碳酸鈣),有氣泡冒出證明含有硫酸;
【拓展應用】(1)根據金屬活動性順序及其應用可知,若將廢液中的硫酸銅全部轉化為硫酸亞鐵,應該加入過量的鐵粉;
(2)由于反應完全后,會生成不溶于水的金屬銅,并且鐵是有剩余的,也不溶于水;所以濾渣中物質為鐵和銅.
故答案為:【提出問題】(1)溶液顯藍色;
(2)鐵絲與稀硫酸(或硫酸銅溶液)反應生成硫酸亞鐵(或反應生成的硫酸亞鐵不與其他物質反應);
【實驗驗證】取少量的廢液于試管中,加入鐵粉或,有氣泡冒出證明含有硫酸;碳酸鈉/碳酸鈣;
【拓展應用】(1)鐵片(或Fe、鐵粉、鐵絲等);
Fe+H2SO4=FeSO4+H2↑(或Fe+CuSO4=FeSO4+Cu);
(2)鐵和銅(或Fe和Cu).
四、(秦皇島中考化學)計算應用題(29題5分,30題5分,共10分,解答時要求有必要的文字說明、公式和計算步驟等,只寫最后結果不得分)
29.測出赤鐵礦中氧化鐵的質量分數為70%,現煉鐵廠利用赤鐵礦石3000t.理論上可煉出含鐵98%的生鐵的質量是多少?
【考點】含雜質物質的化學反應的有關計算.
【分析】由赤鐵礦石和赤鐵礦樣品中氧化鐵的質量分數求出氧化鐵的質量,根據CO還原氧化鐵的反應化學方程式可求出鐵的質量,即可求出生鐵的質量.
【解答】解:赤鐵礦樣品中氧化鐵的質量為:3000t×70%=2100t,
設可煉出含鐵98%的生鐵的質量為x,
Fe2O3+3CO![]() 2Fe+3CO2;
2Fe+3CO2;
160????????????????????? 112
2100t????????????????? 98%x?
![]()
解得:x=1500t.
答:理論上可煉出含鐵98%的生鐵的質量1500噸.
30.某課外小組,用大理石與鹽酸反應制取二氧化碳(大理石雜質不與鹽酸反應).甲、乙、丙三同學分別進行實驗,實驗數據如表(燒杯的質量為25.0g).
| 燒杯+鹽酸 | 大理石 | 充分反應后燒杯+剩余物 |
甲 | 75.0g | 13.2g | 83.8g |
乙 | 75.0g | 16.0g | 86.6g |
丙 | 95.0g | 13.2g | 103.8g |
(1) 甲 同學所取的鹽酸與大理石恰好完全反應.
(2)計算大理石中碳酸鈣的質量分數(計算結果精確到0.1%).
(3)計算恰好完全反應的那位同學所得溶液的溶質質量分數.(計算結果精確到0.1%)
【考點】根據化學反應方程式的計算;有關溶質質量分數的簡單計算.
【分析】(1)對比每組實驗所產生二氧化碳的質量,可發現所得二氧化碳氣體質量相等;據此,各位同學實驗數據,判斷鹽酸與大理石恰好完全反應時稀鹽酸與大理石的質量關系;
(2)利用甲同學所取的鹽酸與大理石恰好完全反應時所得數據,由質量守恒定律計算出反應生成二氧化碳的質量;利用二氧化碳的質量,根據反應的化學方程式,計算反應消耗碳酸鈣的質量,碳酸鈣質量與大理石樣品質量的比可計算大理石中碳酸鈣的質量分數;
(3)根據二氧化碳的質量求出生成氯化鈣的質量,進而求出恰好完全反應的那位同學所得溶液的溶質質量分數即可.
【解答】解:(1)由甲、丙兩同學的實驗數據,產生4.4g二氧化碳需要13.2g大理石完全反應;由甲、乙兩同學的實驗數據,產生4.4g二氧化碳需要75.0g﹣25.0g=50.0g稀鹽酸完全反應;由此可判斷,甲同學所取的鹽酸與大理石恰好完全反應;
故答案為:甲;
(2)設參加反應的大理石的質量為x,生成氯化鈣的質量為y.
生成二氧化碳的質量=75.0g+13.2g﹣83.8g=4.4g
CaCO3+2HCl═CaCl2+H2O+CO2↑
100?????????????????? 111???????????? 44
x?????????????????????? y??????????????? 4.4g
![]()
x=10g
y=11.1g
大理石中碳酸鈣的質量分數=![]() ×100%=75.8%
×100%=75.8%
(3)恰好完全反應所得溶液的溶質質量分數=![]() =19.6%
=19.6%
答:(2)大理石中碳酸鈣的質量分數為75.8%;
(3)恰好完全反應所得溶液的溶質質量分數為19.6%.

孔乙己是貧困潦倒的知識分子。在書中,孔乙己是一個知識分子,滿口“之乎者也”,但是他很窮,還竊書,說過“讀書人的事,怎么能叫竊,”被人嘲笑,他...

自然界產生氧氣的化學方程式:光合作用的反應式為6CO2+12H2O→C6H12O6+6O2+6H2O。包括光反應和暗反應兩個過程。需要具備光...

有的高校沒有條件,只要學業水平成績都合格就可以,比如中國科學院大學。有的需要平常學習考試成績,比如北京外國語大學要求高三第一學期期末成績在全...

在四則運算中,表示計算順序,在小括號之后、大括號之前;表示兩個整數的最小公倍數;表示取未知數的整數部分;在函數中,表示函數的閉區間;在線性代...

濟南開設的最好的職高學校有:濟南方信集團職業高中、濟南公共交通職業高中。濟南市公共交通職業高級中學是由濟南市公共交通總公司承辦,業務屬濟南市...

實然:是說事物實際上就是這樣的,但不同于現實性(現實性指其有合理性和客觀性);應然:就是應該是怎么樣的意思,比如說這件事,就應該是那樣的結果...

地中海氣候一種夏季炎熱干燥、冬季溫和多雨,雨熱不同期的氣候類型。地中海氣候冬季受西風帶控制,鋒面氣旋頻繁活動,氣候溫和,最冷月的氣溫在4-1...

堿石灰,又稱鈉石灰,堿石灰是白色或米黃色粉末,疏松多孔,是氧化鈣(CaO,大約75%),水(H?O,大約20%),氫氧化鈉(NaOH,大約3...